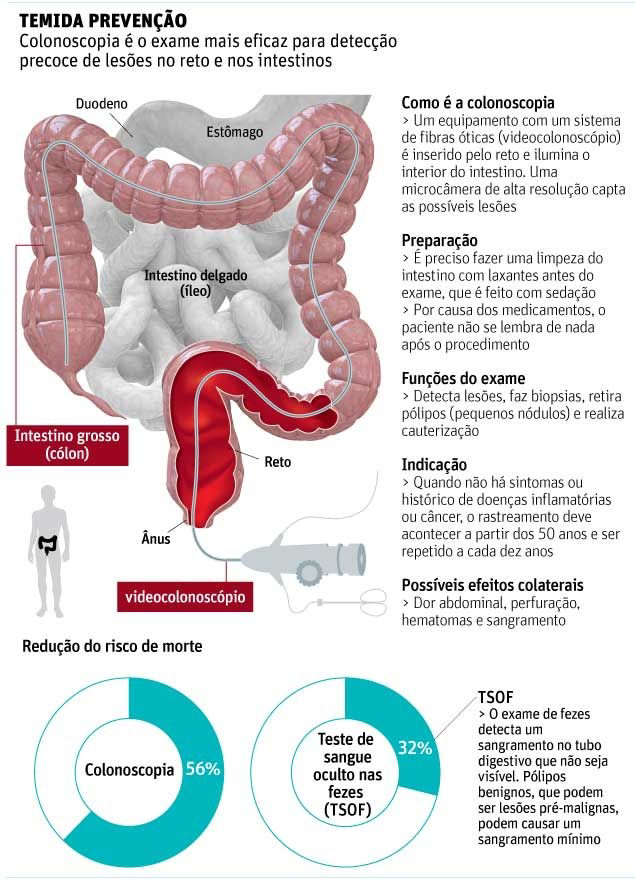
As Glândulas Suprarrenais desempenham papel na regulação da resposta adaptativa do organismo ao estresse, na manutenção do equilíbrio da água corporal, do sódio e do potássio, bem como no controle da pressão arterial.
Os principais hormônios produzidos pelas Glândulas Suprarrenais nos seres humanos pertencem a duas famílias diferentes, com base em sua estrutura:
- Hormônios esteroides: Glicocorticoides, mineralocorticoides e androgênios
- Catecolaminas: Noradrenalina e adrenalina
ANATOMIA E ZONALIDADES FUNCIONAIS DAS GLÂNDULAS SUPRARRENAIS:
Elas estão localizadas acima dos rins, são pequenas, pesando cerca de 6 a 11g, cada, e são constituídas pelo córtex e medula, tendo, cada um deles, uma origem embrionária distinta.
Córtex externo: Deriva do tecido mesodérmico.
Medula interna: Origina-se de uma subpopulação de células da crista neural.
O suprimento sanguíneo para essas glândulas é próprio e provém das artérias suprarrenais superior, média e inferior.
Ramos dessas artérias formam uma rede capilar organizada, de modo a propiciar o fluxo de sangue do córtex externo para a área central, com um sistema de sinusoides.
A drenagem venosa envolve uma única veia renal de cada lado: a veia direita drena na veia cava inferior, enquanto a veia esquerda drena na veia renal esquerda.
Quando essas estruturas são acometidas por necrose, geralmente ocorre a necrose de liquefação por enzimas lisossômicas.
HORMÔNIOS DO CÓRTEX SUPRARRENAL:
O córtex suprarrenal consiste em três zonas:
ZONA GLOMERULOSA:
A Zona glomerulosa contém um retículo endoplasmático liso em quantidade abundante e constitui a única fonte do mineralocorticoide aldosterona.
ZONA FASCICULADA:
A zona fasciculada: possui quantidades abundantes de gotículas lipídicas e produzem os glicocorticoides, cortisol e corticosterona, bem como os androgênios, DHEA (desidroepiandrosterona) e sulfato de DHEA.
ZONA RETICULAR:
A zona reticular desenvolve-se na vida pós-natal e também produz glicocorticoides e androgênios.
As três classes de hormônios produzidos pelo córtex são os glicocorticoides como o cortisol, os mineralocorticoides como a aldosterona e os precursores androgênios suprarrenal como o DHEA.
Os glicocorticoides e os mineralocorticoides atuam em receptores nucleares específicos que regulam uma série de aspectos relacionados a resposta fisiológica ao estresse, a pressão e homeostase de eletrólitos.
Os precursores androgênios são convertidos nas gônadas e nas células alvo-periféricos em esteroides sexuais que atuam via receptores nucleares de androgênios e estrogênios.
GLÂNDULAS SUPRARRENAIS: QUÍMICA E BIOSINTESE:
Os hormônios esteroides compartilham uma etapa inicial, a conversão do colesterol em pregnenolona pela enzima P450scc. Essa etapa é conhecida como etapa limitadora de velocidade e necessita da proteína reguladora de esteroides: A StAR.
GLICOCORTICOIDES:
SÍNTESE E LIBERAÇÃO:
A liberação é estimulada diretamente pelo hormônio adrenocorticotrófico (ACTH), liberado na hipófise. O ACTH é sintetizado na forma de um grande precursor, a pró-opiomelanocortina (POMC).
A estimulação da liberação do cortisol ocorre 15 minutos após o surto de ACTH. A liberação do cortisol é maior durante as primeiras horas de vigília, e os níveis declinem à medida que o dia prossegue. Por sua liberação pulsátil, os níveis variam durante o dia.
A produção dos glicorcorticoides e dos androgênios suprarrenais ocorre pelo controle do eixo hipotálamo-hipófise-suprarrenal (HHSR) e sua síntese é resultado do controle inibitório por retroalimentação do hipotálamo e da hipófise.
MINERALOCORTICOIDES:
A produção dos mineralocorticoides são regulados pelo sistema renina-angiotensina-aldosterona (RAA). A causa mais comum de excesso de mineralocorticoides é o hiperaldosteronismo primário, que é a produção excessiva de aldosterona na zona glomerulosa.
O rastreio diagnóstico para essa condição é recomendado para pacientes com hipertensão associada a resistência a fármacos, hipopotassemia, massa suprarrenal ou início da doença antes dos 40 anos.
DISTÚRBIOS DO CÓRTEX SUPRARRENAL:
Os distúrbios dessa região são caracterizados pela deficiência ou pelo excesso de corticoesteroides, podendo ser apenas de um ou mais desses.
A deficiência hormonal pode ter como causa distúrbios da glândula ou de enzimas – ambos hereditários – ou pela destruição hipofisária ou da glândula suprarrenal por doenças autoimunes, infecções, infartos ou iatrogenia.
A avaliação da deficiência é realizada pela estimulação da produção de cortisol pelo ACTH. O teste padronizado envolve a administração de ACTH 0,25mg por via intramuscular ou intravenosa.
Após a administração do ACTH 1-24, são coletadas a amostra sanguínea em 3 tempos (0, 30 e 60 minutos). A resposta normal é definida por nível de cortisol em valor superior a 20 μg/dL após estimulação.
Já o excesso de hormônio tende a ocorrer no contexto de neoplasia e pode ter como efeito secundário uma das duas das situações abaixo:
- Produção aumentada de ACTH pela hipófise ou por células neuroendócrinas;
- Produção aumentada de glicocorticoides, mineralocorticoides ou precursores androgênicos por nódulos suprarrenais.
O excesso de mineralocorticoides pode ser avaliado pelo teste de renina plasmática.
SÍNDROME DE CUSHING:
A hiperfunção das glândulas suprarrenais origina a Síndrome de Cushing (SC), uma síndrome muito importante devido a múltiplas manifestações clínicas.
A exposição crônica a um excesso de glicocorticoides é o que origina a SC, independe de qualquer etiologia dessa exposição. Esse é um distúrbio que pode ser dependente de ACTH ou independente ou iatrogênico.
Quando nos referíamos à doença de Cushing, o entendimento é de que existe um adenoma de corticotrofos hipofisários, mas a síndrome é mais comum e está geralmente mais associada a administração de glicocorticoides para o tratamento de inflamações.
SINAIS E SINTOMAS DE SÍNDROME DE CUSHING:
Os sinais e sintomas da SC estão associados a ação que os glicocorticoides possuem em quase todas as células do corpo, nesse contexto em ampla quantidade. Esses efeitos incluem suprarregulação:
- gliconeogênese
- lipólise
- catabolismo das proteínas
Dessa forma, compreende-se que os sintomas e sinais costumam a ser o aumento do peso, obesidade central, pletora facial, hirsutismo, osteopenia, osteoporose, hipertensão, edema, miopatia proximais, amenorreia, maior suscetibilidade a infecções, entre outros.
O excesso de glicocorticoides é detectado pelo teste de supressão da dexametasona, que é muito útil para estabelecer o diagnóstico da Síndrome de Cushing.
Pacientes com SC tem risco de eventos trombóticos devido ao estado de hipercoagulabilidade associado à SC, podendo ocorrer trombose venosa profunda e embolia pulmonar.
Manifestações psiquiátricas como depressão ou ansiedade também podem estar presentes.
PROGNÓSTICO E TRATAMENTO:
O prognóstico desses pacientes tende a ser ruim se a SC não for tratada adequadamente. O tratamento pode incluir a terapia para controle imediato do excesso de cortisol.
Os medicamentos via oral mais eficazes no tratamento da SC são a metirapona e o cetoconazol, o primeiro atuando na inibição da síntese de cortisol e o segundo na inibição das etapas iniciais da esteroidogênese.
CATECOLAMINAS:
As catecolaminas são sintetizadas a partir da tirosina e atuam como resposta à estimulação nervosa simpática na região da medula da glândula suprarrenal.
Elas são liberadas geralmente em contexto de estresse à agressões de ordem física ou psicológica com o propósito de manter a atenção e o estado de alerta. Por conta disso, os efeitos das catecolaminas no corpo provocam:
- Sudorese
- Broncodilatação
- Taquicardia
- Piloereção (arrepios)
- Midríase
- Constrição de esfíncteres, principalmente no trato gastrointestinal
- Entre outros.